Introducción
La hemorragia subaracnoidea (HSA) es una de esas urgencias que no dan tregua. Cuando aparece, la mortalidad y la discapacidad pueden ser altas, sobre todo en los primeros días. La forma aneurismática (aHSA) ocurre cuando un aneurisma intracraneal se rompe y llena de sangre el espacio subaracnoideo. Factores como la hipertensión, el tabaquismo y algunas condiciones genéticas aumentan el riesgo.
La buena noticia: el diagnóstico por TAC, los tratamientos endovasculares y los cuidados neurocríticos han mejorado mucho los resultados. Este resumen reúne lo más útil para el servicio de urgencia: cómo pensarla, cómo diagnosticarla y por dónde empezar el manejo.
Definición
La aHSA es la ruptura de un aneurisma dentro del cráneo con salida de sangre al espacio subaracnoideo. El aumento brusco de la presión intracraneal puede provocar isquemia, daño cerebral y otras complicaciones graves. Aquí el tiempo cuenta: diagnóstico rápido y manejo ordenado hacen la diferencia.
Epidemiología
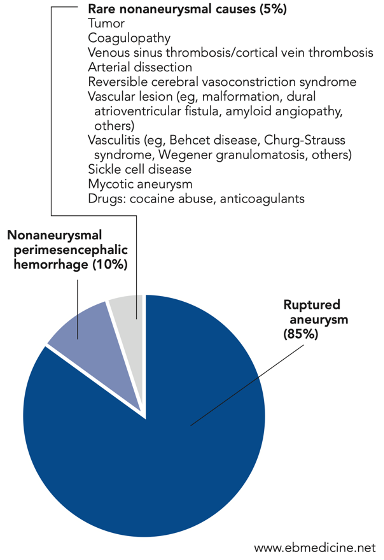
Incidencia. Se estiman 6–8 casos por cada 100.000 habitantes/año, con variaciones según la población y la geografía.
Prevalencia. Alrededor del 2% de la población tiene aneurismas intracraneales, pero la mayoría no se rompen; por eso la HSA es mucho menos frecuente que la presencia de aneurismas.
Mortalidad. Dura y precoz: 25–50% en el primer mes, con el mayor riesgo en los primeros días por el sangrado inicial o el resangrado. A largo plazo, pese a los avances, 30–40% de los sobrevivientes queda con secuelas neurológicas significativas.
Etiología (¿por qué se rompe un aneurisma?)
1) Factores anatómicos
Aneurismas saculares. Son “bolsas” en la pared arterial, típicas en bifurcaciones del círculo de Willis.
Sitios que más sangran:
- Arteria comunicante anterior.
- Arteria comunicante posterior.
- Bifurcación de la arteria cerebral media.
- Arteria basilar.
Debilidad de la pared. Degeneración de la lámina elástica interna y de la media, con fragmentación del colágeno. La hipertensión y el estrés hemodinámico aceleran el daño.
2) Factores genéticos
Historia familiar. Tener un familiar de primer grado con aneurisma aumenta el riesgo.
Trastornos hereditarios.
- Enfermedad renal poliquística autosómica dominante.
- Síndrome de Ehlers-Danlos tipo IV.
Ambos favorecen paredes arteriales más frágiles.
3) Factores adquiridos
Hipertensión. Es el factor modificable más relevante: más presión, más tensión sobre la pared.
Tabaquismo. Inflamación y daño de la pared arterial; riesgo claramente mayor y prevenible.
Alcohol en exceso. Favorece hipertensión y fragilidad vascular.
Drogas simpaticomiméticas. Cocaína y metanfetaminas elevan bruscamente la presión y el estrés hemodinámico.
Factores hormonales. En mujeres posmenopáusicas, la baja de estrógenos podría reducir la protección sobre la pared arterial.
- Fisiopatología
Fisiopatología de la HSA Aneurismática
Hablar de hemorragia subaracnoidea (HSA) aneurismática es hablar de una tormenta repentina dentro del cerebro. Todo comienza cuando un aneurisma intracraneal —esas pequeñas dilataciones silenciosas de las arterias— finalmente cede. A partir de ahí, una cadena de eventos complejos se desencadena en segundos y compromete tanto la perfusión cerebral como la vida misma del paciente.
1. Ruptura del aneurisma
El punto de partida es la rotura del aneurisma sacular, usualmente por una pared arterial que se ha ido debilitando con el tiempo. La hipertensión crónica, el tabaquismo y otros factores inflaman y erosionan esa pared hasta que no resiste más.
Al romperse, la sangre sale a presión hacia el espacio subaracnoideo, elevando bruscamente la presión intracraneal (PIC) y provocando una caída del flujo sanguíneo cerebral. En ese instante, cada segundo cuenta.
2. Efectos inmediatos del sangrado
Esa descarga de sangre actúa como una explosión interna. La PIC aumenta de forma súbita, comprometiendo la perfusión cerebral y generando isquemia transitoria o incluso permanente.
El cerebro responde con inflamación y edema, lo que agrava todavía más la presión y perpetúa el círculo de daño.
3. Irritación meníngea
La sangre fuera de su cauce irrita directamente las meninges. Esa inflamación explica los signos clásicos: rigidez de cuello, fotofobia y cefalea intensa.
Con el paso de las horas, la degradación de la hemoglobina en el líquido cefalorraquídeo produce xantocromía, ese tono amarillento que puede detectarse en el análisis del LCR y confirmar el diagnóstico cuando la TAC no lo muestra.
4. Vasoespasmo cerebral
Días después llega otra amenaza silenciosa: el vasoespasmo. Los productos de degradación de la sangre —en especial la hemoglobina— irritan las arterias cerebrales, haciendo que se contraigan y reduzcan el flujo sanguíneo.
Este fenómeno suele aparecer entre el tercer y décimo día posthemorragia, y es responsable de muchos casos de isquemia cerebral secundaria.
5. Hidrocefalia
La sangre también puede bloquear el flujo normal del líquido cefalorraquídeo (LCR). Cuando eso ocurre, el líquido se acumula en los ventrículos, generando hidrocefalia aguda o crónica.
El aumento resultante de la PIC se traduce en deterioro neurológico progresivo, confusión o incluso pérdida de conciencia.
6. Resangrado
El enemigo más temido en las primeras horas: el resangrado.
Si el aneurisma no se trata a tiempo, la posibilidad de una nueva ruptura es alta, especialmente dentro de las primeras 24 horas, con consecuencias devastadoras.
Por eso, el control estricto de la presión arterial y el tratamiento temprano —ya sea con clipping quirúrgico o embolización endovascular— son medidas decisivas para la supervivencia.
7. Complicaciones sistémicas
La HSA no se queda solo en el cerebro. Puede disparar una respuesta inflamatoria sistémica (SIRS) que afecta corazón, pulmones y riñones.
Las complicaciones cardiovasculares son frecuentes: desde arritmias hasta el síndrome de Takotsubo, una miocardiopatía inducida por estrés y liberación masiva de catecolaminas.
Manifestaciones clínicas
Dolor de cabeza
El síntoma más característico es una cefalea súbita, intensa y explosiva, descrita por muchos pacientes como “el peor dolor de cabeza de mi vida”.
Aparece en segundos, alcanza su máxima intensidad casi de inmediato y a menudo se acompaña de náuseas, rigidez cervical o alteración del nivel de conciencia.
Pérdida de conciencia
En muchos casos, el paciente puede perder el conocimiento por unos segundos o minutos justo al momento de la ruptura del aneurisma. Es un colapso súbito, casi instantáneo, que asusta tanto al entorno como al propio paciente cuando despierta desorientado.
Náuseas y vómitos
El aumento brusco de la presión intracraneal puede provocar náuseas intensas y vómitos en proyectil. No siempre son el primer signo, pero suelen acompañar la cefalea explosiva inicial.
Rigidez de cuello
Una de las claves clínicas clásicas. La irritación meníngea causada por la sangre en el espacio subaracnoideo produce esa sensación de nuca rígida, dolorosa, que limita los movimientos y puede aparecer horas después del inicio.
Fotofobia y fonofobia
El paciente suele cerrar los ojos ante la luz o taparse los oídos ante los ruidos. Esa hipersensibilidad refleja el grado de irritación meníngea y la sobrecarga sensorial del cerebro inflamado.
Dolor lumbar
En algunos casos, el sangrado puede extenderse hacia la médula espinal, provocando dolor lumbar o dorsal bajo, un síntoma que a veces se pasa por alto, pero puede ayudar a completar el cuadro clínico.
Signos clínicos
Hipertensión arterial
No es raro encontrar una presión arterial elevada. Es una respuesta fisiológica al estrés agudo y al aumento de la presión intracraneal, más que una causa directa.
Meningismo
El meningismo se evidencia con rigidez de nuca y signos de irritación meníngea clásicos como el signo de Kernig, positivo cuando la extensión de la rodilla resulta dolorosa o limitada.
Hemorragias retinianas
A veces, el fondo de ojo muestra un hallazgo característico: el síndrome de Terson. Son hemorragias preretinales o vítreas producidas por el aumento repentino de la presión intracraneal, visibles en la exploración oftalmológica.
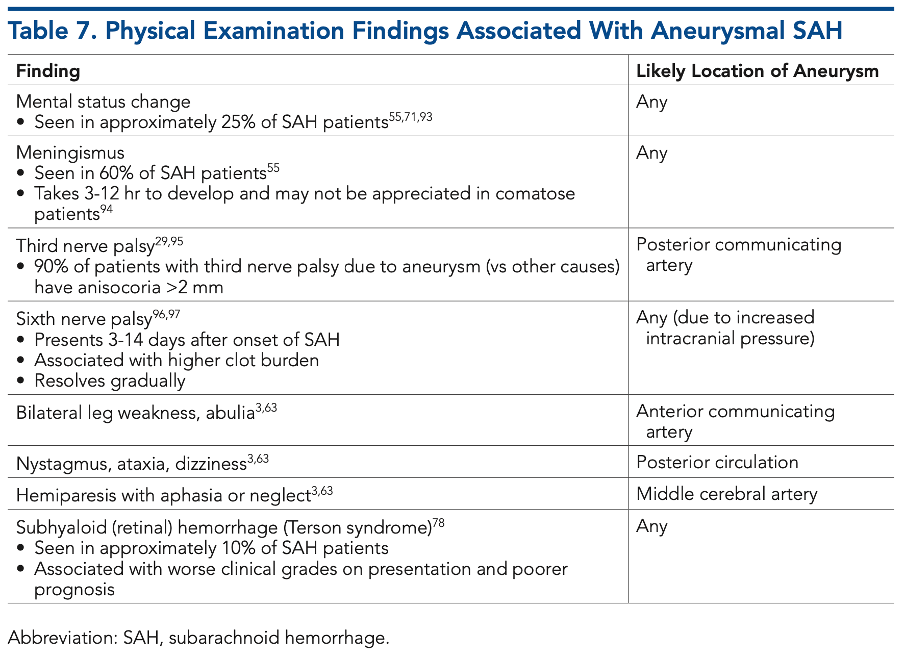
Déficits neurológicos focales
Dependiendo del sitio donde ocurrió la hemorragia o del aneurisma comprometido, pueden aparecer déficits motores, alteraciones del lenguaje o pérdida de la visión. Estos signos orientan hacia la localización anatómica del sangrado.
Signos de irritación meníngea
El signo de Brudzinski es otro clásico: al flexionar el cuello del paciente, las caderas y rodillas se flexionan de manera involuntaria. Es una respuesta refleja a la inflamación meníngea.
Paresias de nervios craneales
En particular, la afectación del tercer par craneal (oculomotor) puede ser una pista valiosa: ptosis palpebral, midriasis y desviación del ojo hacia afuera y abajo. Este hallazgo debe hacer sospechar un aneurisma de la arteria comunicante posterior, una localización frecuente en la HSA aneurismática.

Diferenciales
Cuando un paciente llega con un dolor de cabeza súbito, intenso, que describe como “el peor de su vida”, es inevitable pensar en una HSA. Pero no todo dolor en trueno lo es. Existen otras causas que pueden imitarla, y conocer las diferencias puede evitar errores y, sobre todo, retrasos en el diagnóstico.
1. Migraña
Las migrañas pueden ser traicioneras: dolor intenso, unilateral, pulsátil, a veces acompañado de aura visual o sensorial.
La clave está en el inicio gradual y en la historia clínica. Quien ya ha tenido crisis previas lo reconoce. Además, en la migraña, la TAC y la punción lumbar resultan completamente normales.
2. Cefalea en trueno (Thunderclap headache)
Es el gran imitador. El dolor es súbito, explosivo, y alcanza su punto máximo en segundos, igual que la HSA.
La diferencia está en los estudios: la TAC y la punción lumbar son esenciales. Si el líquido cefalorraquídeo no muestra xantocromía, se descarta HSA. A veces esta cefalea es idiopática, otras se relaciona con encefalopatía hipertensiva o disección arterial.
3. Accidente cerebrovascular isquémico (ACV)
El déficit neurológico focal es el protagonista: hemiparesia, afasia, pérdida visual…
El dolor de cabeza, si aparece, es secundario. En la TAC inicial, el parénquima puede verse normal, pero la angiografía o la resonancia confirman la isquemia.
4. Hemorragia intracerebral
En este caso también hay dolor de cabeza y signos neurológicos, pero la TAC muestra sangre dentro del tejido cerebral, no en el espacio subaracnoideo.
La localización y la historia de hipertensión crónica ayudan a orientar.
5. Meningitis o encefalitis
Aquí el cuadro suele ir acompañado de fiebre, rigidez de cuello y alteración del sensorio.
En la punción lumbar, el líquido muestra pleocitosis y datos de infección, no xantocromía. La presencia de leucocitos en el LCR y el contexto febril marcan la diferencia con la HSA.
6. Síndrome de vasoconstricción cerebral reversible (SVCR)
Dolor de cabeza tipo trueno, recurrente, con síntomas neurológicos transitorios.
La angiografía revela una vasoconstricción segmentaria que mejora en semanas o meses. La ausencia de sangre en el LCR y la reversibilidad de los hallazgos son las pistas que orientan el diagnóstico.
7. Disección arterial cervical
Puede simular tanto una HSA como un ACV. Aparece con dolor súbito en el cuello o la cabeza, seguido de signos isquémicos.
Suele haber una historia de trauma menor o movimiento brusco del cuello. La angiografía muestra la disección, y tanto la TAC como la punción lumbar son normales.
Claves para distinguir la HSA del resto
- Escuchar la historia: cómo empezó el dolor, qué lo desencadenó, si hubo pérdida de conciencia o antecedentes similares.
- Explorar con detalle: signos meníngeos, rigidez de nuca, déficits focales, estado mental.
- Tomografía computarizada (TAC): la primera gran herramienta. Detecta la sangre en el espacio subaracnoideo.
- Punción lumbar (PL): si la TAC es negativa pero la sospecha sigue alta, el análisis del LCR con xantocromía y recuento de glóbulos rojos despeja dudas.
- Angio-TAC o angiografía digital (DSA): sirven para identificar aneurismas o alteraciones vasculares responsables del sangrado.
En resumen, aunque la cefalea en trueno siempre enciende las alarmas, la historia clínica y la evaluación sistemáticason las verdaderas herramientas para separar la HSA de otros diagnósticos. En urgencias, actuar rápido, pero con método, es lo que marca la diferencia entre un susto y una tragedia.
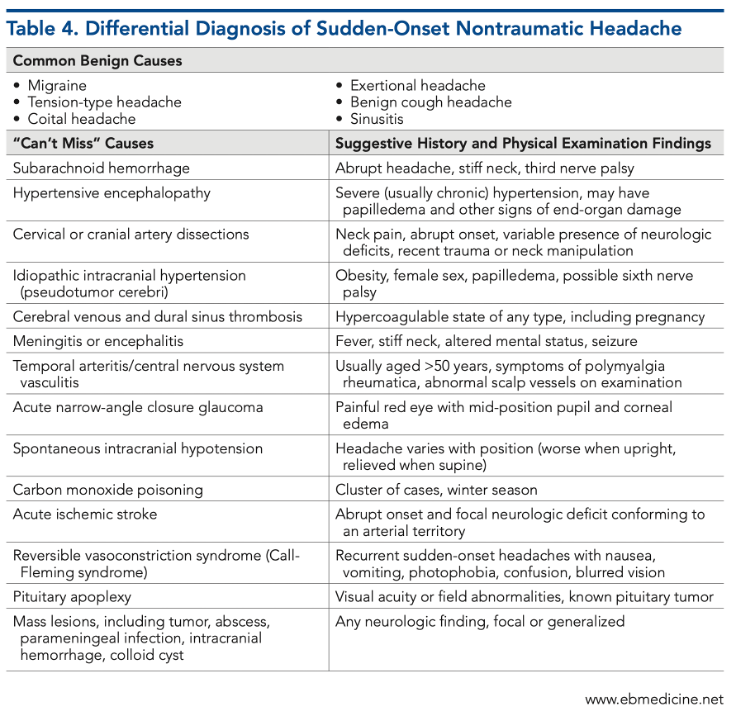
- Diagnóstico de la Hemorragia Subaracnoidea (HSA) Aneurismática
El diagnóstico de una HSA aneurismática no se deja al azar. Requiere una mirada clínica entrenada y el uso estratégico de las herramientas de imagen. Cada paso cuenta: reconocer el cuadro, confirmar el sangrado y localizar el aneurisma responsable.
1. Evaluación clínica inicial
Todo empieza con una buena historia clínica. Es esencial preguntar cómo empezó el dolor, si fue súbito o progresivo, si hubo pérdida de conciencia, vómitos, rigidez cervical o crisis convulsivas. Muchas veces, el relato del paciente o de un testigo orienta más que cualquier examen.
En la exploración física, el foco está en buscar signos de meningismo (rigidez de nuca, fotofobia), medir la presión arterial y evaluar si existen déficits neurológicos focales. Una desviación ocular, una hemiparesia o una pupila dilatada pueden dar pistas sobre la localización del aneurisma o la gravedad del sangrado.
2. Estudios de imagen
Tomografía computarizada (TAC) de cráneo sin contraste
Es la primera herramienta diagnóstica y la más decisiva en la fase aguda. Su sensibilidad es altísima si se realiza dentro de las primeras seis horas desde el inicio del dolor: entre 98% y 100%.
Después de ese tiempo, la sensibilidad disminuye gradualmente:
Entre 6 y 12 horas, ronda el 90%.
Más allá de 24 horas, puede caer hasta 50–85%.
La especificidad, sin embargo, sigue siendo excelente (98–100%).
En la TAC, la sangre aparece como áreas hiperdensas en el espacio subaracnoideo, sobre todo en las cisternas basales y perimesencefálicas. Si el sangrado es masivo, puede extenderse a los ventrículos o al parénquima cerebral.
3. ¿Qué hacer si la TAC es negativa?
Si la sospecha clínica sigue siendo alta, el siguiente paso es la punción lumbar (PL). La presencia de xantocromía —ese color amarillento del líquido cefalorraquídeo— confirma el sangrado, incluso cuando la TAC no lo muestra.
Es clave realizarla después de 12 horas del inicio de los síntomas, para dar tiempo a la degradación de la hemoglobina.
4. Localización del aneurisma
Una vez confirmado el diagnóstico, toca identificar el origen del sangrado. La angiografía por tomografía computarizada (CTA) o la angiografía digital (DSA) son las herramientas de elección.
Permiten visualizar el aneurisma, su tamaño, forma y localización, información indispensable para planificar el tratamiento —ya sea clipado quirúrgico o embolización endovascular.
En resumen
Ante un dolor de cabeza súbito e intenso (Ictal), la TAC sin contraste dentro de las primeras horas es la piedra angular del diagnóstico. Si la imagen es negativa, pero el cuadro sigue sospechoso “HSA”, la punción lumbar es el siguiente paso obligado.
Confirmado el sangrado, la angiografía cerrará el círculo, mostrando el aneurisma culpable y guiando el manejo definitivo.



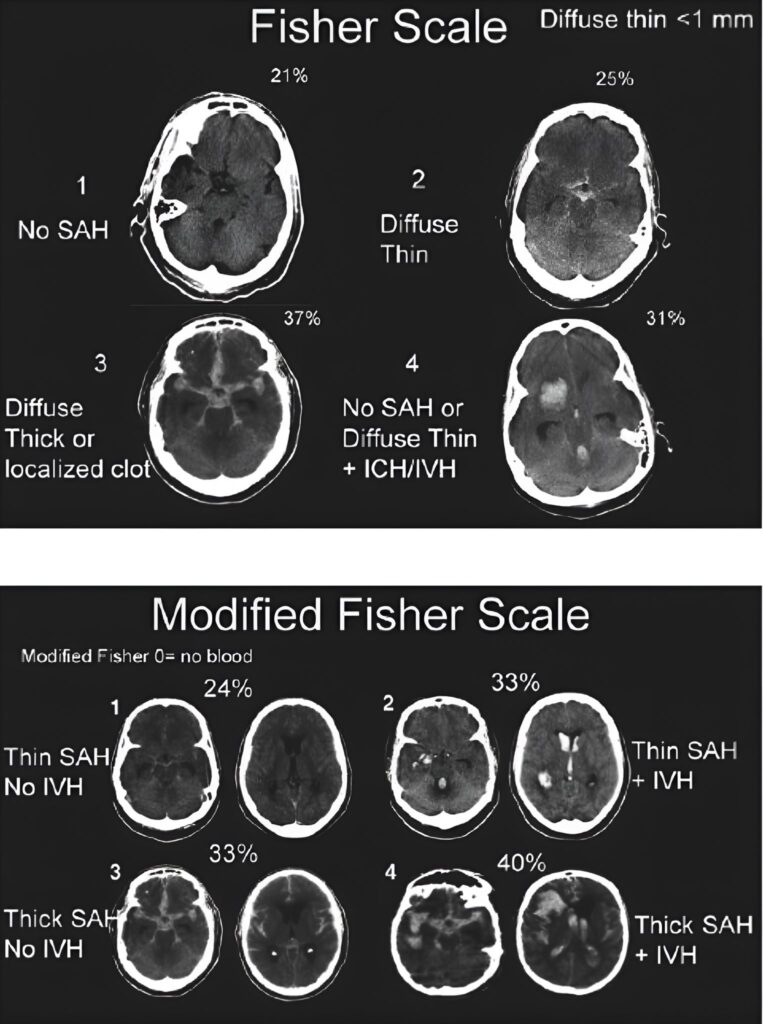

Punción Lumbar y Estudios Angiográficos en la Sospecha de HSA
Cuando la tomografía de cabeza no muestra nada, pero el paciente sigue con ese dolor de cabeza en trueno, el que te hace pensar “esto no es una cefalea cualquiera”, hay que seguir buscando. En ese escenario, la punción lumbar (PL)cobra todo el sentido.
¿Cuándo hacer una punción lumbar?
La PL está indicada cuando hay una sospecha clínica fuerte de hemorragia subaracnoidea (HSA) —por ejemplo, un dolor de cabeza súbito e intenso, rigidez de cuello o vómitos—, pero la tomografía (TAC) resulta negativa o poco concluyente.
Esto ocurre con frecuencia cuando el estudio se hace más de seis horas después del inicio de los síntomas, momento en que la sensibilidad de la TAC empieza a caer.
En otras palabras: si el cuadro grita HSA pero la imagen calla, no des por cerrado el caso.
Cuando la sospecha persiste…
Si a pesar de una TAC limpia sigues con la intuición de que hay algo más, el siguiente paso es claro: hacer una PL.
Lo que buscamos es xantocromía en el líquido cefalorraquídeo (LCR), ese tono amarillento que aparece cuando la sangre se degrada y la hemoglobina se convierte en bilirrubina.
💡 Este hallazgo es prácticamente una firma diagnóstica de HSA.
La espectrofotometría puede confirmar la xantocromía con mayor precisión.
Eso sí, hay que tener paciencia: el examen es más confiable si la punción se realiza al menos 12 horas después del inicio de los síntomas, cuando ya hubo tiempo para que ocurra la degradación de la sangre.
¿Qué hallazgos podemos esperar?
- Xantocromía en el LCR: indica que hubo sangre en el espacio subaracnoideo.
- Recuento elevado de glóbulos rojos: sugiere un sangrado reciente.
Pero ojo: si los glóbulos rojos disminuyen entre los tubos recolectados, probablemente fue una punción traumática; si se mantienen altos en todos, el diagnóstico de HSA gana fuerza.
En resumen: la PL puede ser decisiva, sobre todo cuando la TAC inicial no lo fue.
Estudios Angiográficos: CTA y DSA
Una vez confirmado el sangrado, el siguiente paso es encontrar el aneurisma responsable. Aquí entran en juego dos herramientas: la angiografía por tomografía computarizada (CTA) y la angiografía por sustracción digital (DSA).
Angiografía por Tomografía Computarizada (CTA)
La CTA es rápida, accesible y menos invasiva que la angiografía convencional.
Permite visualizar los aneurismas intracraneales, definir su tamaño, forma y ubicación, e incluso detectar signos de vasoespasmo.
En la práctica, la CTA suele ser suficiente para tomar decisiones iniciales, aunque la DSA sigue siendo el estándar de oro cuando los hallazgos son dudosos o se requiere planificación precisa antes del tratamiento endovascular.
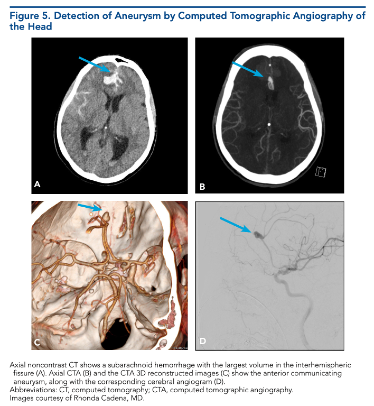
Estudios Complementarios en la Evaluación de la HSA
Una vez que confirmamos el sangrado, el siguiente paso es ir directo a la raíz del problema: encontrar el aneurisma responsable y entender su anatomía.
Para eso contamos con varias herramientas, cada una con su rol y momento ideal.
Angiografía por Sustracción Digital (DSA)
La DSA sigue siendo el estándar de oro cuando se trata de evaluar aneurismas intracraneales con precisión.
Es el estudio más detallado, el que permite ver los vasos con una claridad quirúrgica, y lo mejor: da la posibilidad de tratar en el mismo procedimiento.
En manos experimentadas, la DSA no solo diagnostica, sino que también ofrece la opción de embolizar el aneurismaahí mismo, evitando un segundo paso.
En resumen: si se necesita una visión exacta y la posibilidad de actuar de inmediato, la DSA es la herramienta clave.
Resonancia Magnética (MRI) y Angiografía por Resonancia Magnética (MRA)
Estas técnicas no siempre son el primer paso, pero tienen su espacio.
Se utilizan sobre todo cuando los resultados de la CT o la CTA no son concluyentes, o cuando se busca una evaluación más detallada de la vasculatura cerebral.
Además, la resonancia es útil en pacientes donde la radiación o el contraste yodado pueden representar un riesgo.
Son estudios más finos, ideales para ver la estructura, los flujos y los pequeños detalles anatómicos que podrían pasar desapercibidos en otros métodos.
Evaluación Cardiovascular
No hay que perder de vista algo importante: el cerebro y el corazón se comunican más de lo que parece.
En el contexto de una hemorragia subaracnoidea, el estrés fisiológico puede desencadenar complicaciones cardíacas—desde cambios electrocardiográficos hasta miocardiopatía por estrés (sí, el famoso síndrome de Takotsubo)—.
Por eso, la identificación temprana de estas alteraciones y su manejo oportuno son esenciales para mejorar la evolución del paciente.
No basta con tratar la hemorragia; hay que cuidar al corazón también.
Monitorización y prevención de complicaciones
La hemorragia subaracnoidea aneurismática (HSAa) es, en esencia, una carrera de resistencia. Desde el ingreso, cada minuto cuenta. El objetivo es anticiparse: vigilar, prevenir y actuar antes de que el paciente se complique.
1. Monitorización neurológica
Valoraciones seriadas.
El seguimiento neurológico frecuente (GCS, exploración focal, pupilas, lenguaje) es la piedra angular. Los pequeños cambios avisan antes que el TAC. No esperes el deterioro: detecta la tendencia.
Doppler transcraneal (TCD).
Una herramienta simple pero poderosa. Permite monitorear el flujo cerebral y detectar vasoespasmo antes de que aparezca clínicamente. Si las velocidades suben, algo se está estrechando. Tómatelo en serio.
2. Monitorización hemodinámica
Presión arterial.
El control estricto de la presión es clave para evitar el resangrado, pero también para no caer en hipotensión que comprometa la perfusión cerebral.
El rango recomendado por las guías actuales es una PAS entre 140–160 mmHg o una PAM ≤110, individualizando según contexto y estado general.
Fármacos más usados:
- Labetalol: 10–20 mg IV en bolo; repetir cada 10 min (20–40 mg) o continuar 1–2 mg/min.
- Nicardipina: iniciar 5 mg/h IV y titular de 2.5 mg/h cada 5–15 min hasta 15 mg/h.
- Esmolol: bolo 500 mcg/kg, luego infusión de 50–300 mcg/kg/min.
- Nitroprusiato: 0.25–0.5 mcg/kg/min (máx. 10 mcg/kg/min), con vigilancia estricta por riesgo de toxicidad por cianuro.
Función cardíaca.
Monitoriza el gasto y la contractilidad, especialmente si sospechas miocardiopatía por estrés. En estos casos, menos catecolaminas y más criterio: maneja el corazón y el cerebro en conjunto.
3. Monitorización intracraneal
Presión intracraneal (PIC).
El monitoreo invasivo se reserva para casos de hipertensión intracraneal severa, aunque cada vez se usa más dentro de un enfoque multimodal con TCD y parámetros clínicos.
Hidrocefalia.
Aparece con frecuencia en los primeros tres días (≈20–30%). Hay que buscarla activamente en TAC.
Si es sintomática o el paciente está comatoso, la opción es drenaje ventricular externo (DVE) o drenaje lumbar según el caso. No esperes que la presión te lo diga: búscala, porque puede revertir rápido un deterioro.
4. Monitoreo del LCR: drenaje ventricular externo
El DVE no solo permite drenar y medir el LCR: también ayuda a controlar la PIC y mejorar el confort del paciente. Requiere protocolos claros de asepsia y metas definidas de drenaje.
En hidrocefalia aguda, es la medida de rescate más eficaz.
Prevención del resangrado
Ácido tranexámico (ATX).
El riesgo de resangrado es máximo en las primeras 24 horas. El ATX puede reducirlo de manera significativa, pero solo se recomienda como puente corto hasta asegurar el aneurisma (clip o coil).
En los estudios más consistentes (como ULTRA), los regímenes más usados fueron:
1 g IV de carga + 1 g cada 8 horas, hasta oclusión definitiva, por un máximo de 24 horas.
No mejora el pronóstico funcional si se prolonga más allá de ese periodo.
Control de presión arterial.
Mantén una PAS <160 mmHg, evitando caídas bruscas que comprometan perfusión. Labetalol y nicardipina son los más predecibles.
Aseguramiento temprano del aneurisma
El aneurisma debe asegurarse lo antes posible —idealmente dentro de las primeras 24 horas— mediante clipping quirúrgico o embolización endovascular.
Clipping quirúrgico.
Consiste en una craneotomía para colocar un clip en el cuello del aneurisma, aislándolo del flujo.
- Ventajas: solución definitiva, bajo riesgo de resangrado posterior.
- Desventajas: cirugía mayor, anestesia general y recuperación prolongada.
- Indicaciones: aneurismas accesibles, cuello ancho, pacientes con buen estado general.
Embolización endovascular (coiling).
Se introduce un catéter por vía femoral hasta el aneurisma y se rellenan coils de platino para ocluirlo.
- Ventajas: menos invasiva, recuperación rápida, útil en alto riesgo quirúrgico.
- Desventajas: riesgo de recurrencia y necesidad de reintervenciones.
- Indicaciones: aneurismas difíciles de abordar quirúrgicamente o con cuello estrecho.
La elección debe hacerse con el equipo neurovascular completo (neurocirugía, neurorradiología, UCI).
Prevención del vasoespasmo y daño isquémico
Nimodipino siempre.
Se mantiene como el único fármaco con evidencia sólida para reducir la isquemia cerebral retardada y mejorar los desenlaces funcionales, más allá del vasoespasmo angiográfico.
Dosis: 60 mg VO cada 4 horas por 21 días (por SNG si no tolera VO).
Cuidado: puede causar hipotensión; si ocurre, ajustar dosis y apoyar con fluidos o vasoactivos.
TCD seriado.
Permite detectar el vasoespasmo precozmente y ajustar la terapia a tiempo.
Si el paciente no mejora o el flujo sigue comprometido, considerar:
- Angioplastia intraarterial.
- Vasodilatadores intraarteriales según protocolo del centro.
Prevención de la hidrocefalia
Vigilar activamente. Es más frecuente en fase aguda/subaguda.
Colocar DVE en casos sintomáticos o con signos de hipertensión intracraneal. Reevaluar periódicamente con TAC y ajustar metas de drenaje.
Prevención de complicaciones médicas
Infecciones.
Asepsia rigurosa en todos los accesos y drenajes. Cumplir bundles y utilizar antibióticos solo cuando corresponda.
Electrolitos.
Monitorizar sodio y otros electrolitos. Corregir de forma gradual; los cambios bruscos solo suman daño cerebral.
Convulsiones: a quién, con qué y cuánto
¿Quiénes son de alto riesgo?
Pacientes con sangrado parenquimatoso, aneurismas temporales, crisis previas o PIC elevada.
Profilaxis selectiva (no universal).
- Levetiracetam: 500–1000 mg c/12 h (VO/IV), bien tolerado, pocas interacciones.
- Fenitoína/Fosfenitoína: carga 15–20 mg/kg IV; mantenimiento 4–6 mg PE/kg/día. Requiere niveles.
- Valproato: 15–20 mg/kg/día (VO/IV), útil si otras contraindicadas. Vigilar hígado y plaquetas.
- Lacosamida: 100 mg c/12 h, eficaz y bien tolerada.
- Carbamazepina: 200 mg c/12 h, útil en crisis focales; requiere niveles y control de interacciones.
Duración: individualizar. Si no hay crisis y el riesgo baja, retirar progresivamente.
Soporte hemodinámico en miocardiopatía por estrés
Cuando aparece disfunción cardíaca inducida por catecolaminas, ajustar el volumen, usar inotrópicos con juicio y coordinar con cardiología. No son dos órganos separados: lo que hagas al corazón impacta el cerebro.
Trabajo en equipo
La HSAa no se maneja en solitario. Se necesita un equipo sincronizado: urgenciólogos, neurocirujanos, neurorradiólogos, intensivistas, cardiólogos, enfermería y rehabilitación.
Un solo plan, una sola voz. Eso marca la diferencia.
Resultados y pronóstico
- Mortalidad temprana: entre 25 y 50% en el primer mes, sobre todo en los primeros días por impacto inicial o resangrado.
- Mortalidad a largo plazo: ha mejorado gracias a las técnicas modernas, pero sigue siendo considerable.
- Morbilidad: muchos pacientes quedan con déficit neurológico variable.
- Calidad de vida: afectada por secuelas cognitivas, motoras o sensoriales.
- Recuperación: con diagnóstico precoz y manejo oportuno, algunos logran volver a su funcionalidad previa.
- Rehabilitación: física, ocupacional y cognitiva desde etapas tempranas es esencial para recuperar independencia.
Referencias
Edlow JA, Malek AM, Ogilvy CS. Aneurysmal subarachnoid hemorrhage: update for emergency physicians. J Emerg Med. 2008;34(3):237–251.
Suarez JI, Tarr RW, Selman WR. Aneurysmal subarachnoid hemorrhage. N Engl J Med. 2006;354(4):387–396.
Connolly ES, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage. Stroke. 2012;43:1711–1737.
van Donkelaar CE, et al. Predictive factors for rebleeding after aHSA. Stroke. 2015;46:2100–2106.
Laidlaw JD, Siu KH. Ultra-early surgery for aHSA. J Neurosurg. 2002;97:250–258.
Chua MH, et al. Improved outcomes for intracranial aneurysm management over 15 years. Stroke. 2016;47:708–712.
Molyneux AJ, et al. ISAT: clipping vs coiling in ruptured aneurysms. Lancet. 2005;366:809–817.
Lindgren A, et al. Coiling vs clipping for aHSA. Cochrane Database Syst Rev. 2018;CD003085.
Molyneux AJ, Birks J, Clarke A, Sneade M, Kerr RS. Durability of coiling vs clipping: 18-year follow-up (ISAT UK cohort). Lancet. 2015;385:691–697.
Hillman J, et al. Immediate tranexamic acid reduces early rebleeding after aHSA. J Neurosurg. 2002;97:771–778.
Dubosh NM, Bellolio MF, Rabinstein AA, et al. Sensitivity of early CT to exclude aHSA: systematic review and meta-analysis. Stroke. 2016;47(3):750–755.
Rabinstein AA, Friedman JA, Weigand SD, et al. Predictors of cerebral infarction in aHSA. Stroke. 2004;35(8):1862–1866.

0 comentarios